胰腺癌病因、诊断和治疗研究现状
上海交通大学附属第一人民医院 陆颖影 王兴鹏
 尽管胰腺癌在影像学诊断、化疗、围手术期治疗和系统治疗方面取得了一定进展,但胰腺癌患者的生存率和死亡率与以前相比无显著降低。所有分期的胰腺癌患者1年生存率约为20%,5年生存率只有不到5%。尽管外科手术是胰腺癌治疗的基石,并且是治愈肿瘤唯一可能的有效方法,但所有患者仍会在术后7年内死亡。以下结合近年研究进展对胰腺癌的病因、危险因素、临床症状和体征、诊断及治疗进行介绍,供读者参考。
尽管胰腺癌在影像学诊断、化疗、围手术期治疗和系统治疗方面取得了一定进展,但胰腺癌患者的生存率和死亡率与以前相比无显著降低。所有分期的胰腺癌患者1年生存率约为20%,5年生存率只有不到5%。尽管外科手术是胰腺癌治疗的基石,并且是治愈肿瘤唯一可能的有效方法,但所有患者仍会在术后7年内死亡。以下结合近年研究进展对胰腺癌的病因、危险因素、临床症状和体征、诊断及治疗进行介绍,供读者参考。
胰腺癌病因及危险因素
众所周知,遗传和环境因素是胰腺癌的主要病因。男性胰腺癌发病率高于女性,60~80岁的高龄人群易发胰腺癌。
大约10%的胰腺癌发病归因于遗传因素,家族性乳腺癌、遗传性非息肉性结肠癌、Peutz-Jeghers综合征和家族性非典型性多发性黑色素瘤是与胰腺癌相关的家族性肿瘤综合征。有胰腺癌家族史的患者17%存在BRCA2突变,这可能是胰腺癌最重要的基因突变。在同时存在胰腺癌和黑素瘤的家族中还发现了p16INK4a突变。
种族因素可能影响胰腺癌的自然病程。在美国进行的一项纳入1万多例患者的研究中,与黑人和白人相比,亚洲人癌症发病率较低。对该现象目前还没有明确的解释,可能要归因于环境暴露和遗传因素。
吸烟是胰腺癌的一个确切危险因素。吸烟者胰腺癌发病危险是不吸烟者的1.5~3倍。脂肪含量高的饮食也与胰腺癌相关。工作中经常接触甲醛、有机氯或氯化烃等物质也会导致罹患胰腺癌的危险增加。
慢性胰腺炎、糖尿病、胆石症和病理性肥胖等疾病可能增加胰腺癌危险。有酒精性和非酒精性慢性胰腺炎病史者,其胰腺癌发病危险增加10~20倍,有遗传性胰腺炎病史者胰腺癌累计危险较有其他任何已知危险因素者高30%~40%,但是大约只有3%~4%的胰腺癌可能与慢性胰腺炎有关。2型糖尿病患者胰腺癌发病危险增加1.3~2倍,胆石症在胰腺癌发病中的作用还不确定。与体质指数正常者相比,肥胖患者发生胰腺癌的危险估计为19%。
 胰腺癌的诊断临床症状和体征 胰腺癌的诊断临床症状和体征
胰腺癌常没有特异性的早期预警症状,只有当肿瘤足够大,影响胃、肝或邻近器官功能时才出现症状。腹痛和消瘦可能是首发症状。胰腺癌疼痛是一种模糊的上腹疼痛,可放射至背部,仰卧位加重,蜷缩位减轻。据报道,腹痛或背痛可能是肿瘤已不可切除的一种不详预兆。Kelsen发现,没有疼痛的胰腺癌55%可切除,而有疼痛的胰腺癌只有25%可切除。与此相似,没有疼痛的胰腺癌在可切除阶段,患者的中位生存期为21.9个月,而有疼痛的胰腺癌,患者中位生存期仅为9.2个月。
在少数患者中,迟发型糖尿病或原因不明的急性胰腺炎发作可能是胰腺癌的首发症状。50岁前患胰岛素依赖性糖尿病者、非肥胖者和有糖尿病家族史者,发生胰腺癌的可能性增大。约80%的胰腺癌发生在胰头,引起阻塞性黄疸,还可能存在Courvoisier症。胃排空延迟引起的消化不良和十二指肠梗阻引起的呕吐可能是晚期胰腺癌的表现。另外,胆道梗阻引起排便习惯改变和腹泻也可能是晚期胰腺癌的另一种症状。有些临床特征如体重快速下降、腹水、腹块以及锁骨上淋巴结病通常预示肿瘤已不可切除。
 影像学检查 影像学检查
影像学技术的发展使小肿瘤和早期阶段肿瘤得以及时诊断,但是不能诊断出剖腹手术才能发现的小肿瘤、肝脏转移灶或腹膜播散。
1. 增强CT
增强CT被认为是胰腺癌分期的金标准,其预测胰腺癌是否可切除的精确性达90%~100%。由于增强CT检测淋巴结转移、微小局部肿瘤扩散、小的肝转移病灶和直径<1
cm胰腺癌的精确性低,故鉴别潜在可切除的小肿瘤欠精确。据报道,螺旋CT在确定肿瘤的可切除性、原发肿瘤的范围、局部扩散、血管浸润和远处转移方面的精确性分别为83%、73%、74%、83%和88%。
2. 超声内镜(EUS)
EUS为首选的影像学诊断方法,结合胃和十二指肠扫描能有效评估整个胰腺并发现微小病变。EUS对肿瘤分期诊断的精确性为78%~94%,对淋巴结分期的精确性为64%~82%。EUS引导下的细针穿刺(EUS-FNA)可对原发肿瘤、淋巴结和远处转移灶进行组织学诊断,当EUS-FNA
结果不影响胰腺癌治疗时,为防止肿瘤播散,应避免此项操作。与CT相比,EUS在判断肿瘤大小和淋巴结受累方面更精确,对于可切除性胰腺癌是一种性价比最高的诊断方法。
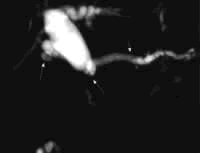
3. 磁共振成像(MRI)
对胰腺癌分期的作用,MRI等同于或优于CT,MRI诊断肿瘤肝转移的能力高于CT,诊断淋巴结浸润的精确性与CT相似。磁共振胰胆管成像(MRCP)和磁共振血管成像(MRA)能提供胰胆管异常和血管受累的额外信息(图2)。
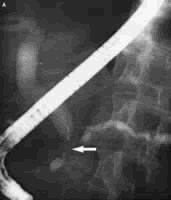
4.内镜逆行胰胆管造影(ERCP)
ERCP可以提供主胰管及其分支的详细胰造影图像,揭示导管系统的形态学改变(图3)。ERCP下可以进行胰管的活检、刷细胞学检查,收集胰液进行细胞学检查和基因分析,引入胰管内超声探头有助于诊断导管内和胰腺实质内病变。
5. 腹腔镜检查
腹腔镜检查能够鉴别小的腹膜或肝转移灶,同时联合腹腔镜超声(LUS)和腹膜细胞学检查,能在10%~35%的患者中发现腹腔和肝内隐性转移灶,其他影像学检查无法发现这些病灶。
没有一种单一的影像学检查可以对胰腺癌进行诊断和分期,即使联合应用仍有1/3以上不可切除性肿瘤被漏诊。为了避免不必要剖腹探查的花费和并发症,手术前常规使用腹腔镜诊断可切除性肿瘤是合理的。
胰腺癌治疗
标准胰十二指肠切除术(PD)和扩大淋巴结清除术(ELND)
既往的一些非随机回顾性研究提示, 对胰腺癌患者进行ELND可以提高长期生存率。随后的一些前瞻性随机研究比较了PD和ELND的治疗效果。
在Pedrazzoli等进行的多中心随机研究中,81例胰头癌患者分别接受标准PD或ELND治疗,但两组生存率无显著差异。Farnell等的研究也显示,接受ELND的患者并未达到更长的生存期。近期一些前瞻性研究也未能证明根治性手术能提高胰腺癌患者生存率。
标准胰十二指肠切除术和保留幽门的胰十二指肠切除术(PPPD)
一些随机前瞻性试验观察了PD和PPPD治疗胰头癌的有效性,Seiler等的研究纳入了110例患者,结果显示上述两种手术疗效相同,只是接受PPPD的患者手术时间可能较短、失血减少,并且术后6个月就能恢复工作。但两组患者的总生存率、肿瘤复发率和生活质量无差异。
辅助治疗
1. 可切除性胰腺癌
可切除的肿瘤只占胰腺癌的15%~20%,考虑到单独外科手术治愈率低,研究者们试图通过一些辅助治疗来提高生存率。
欧洲胰腺癌研究组试验1(ESPAC-1)显示,可切除性胰腺癌术后切缘癌细胞阴性,随即进行全身化疗对延长患者生存率有一定作用。ESPAC-3比较了单独手术治疗和术后辅助吉西他滨或5-FU化疗的疗效,其他研究包括联合应用化学免疫抑制剂和放疗或动脉内应用细胞生长抑制剂。
对可切除性胰腺癌,术后辅助治疗似乎可提高生存率。化放疗可能对手术切缘癌细胞阳性的患者有用。化疗、放疗以及一些以生长因子受体或血管内皮生长因子(VEGF)受体为靶向的治疗对胰腺癌的疗效仍需要大规模随机试验来评估。
2. 局部浸润性胰腺癌
局部浸润性胰腺癌指肿瘤扩展到邻近器官,完整切除并保持切缘癌细胞阴性已不可能。在美国,放疗联合化疗是针对局部浸润性胰腺癌的主要治疗方法。GITSG和ECOG研究是评估化疗或放化疗对局部浸润性胰腺癌作用的两个主要临床试验,联合5-FU化放疗的潜在益处是使局部肿瘤得到控制,改善手术切除率(约3%~20%),缓解临床症状,大约10%的患者有长期生存可能。到目前为止,联合5-FU的放化疗仍是局部浸润性胰腺癌的标准治疗方法。
3. 转移性胰腺癌
1996年前,5-FU是胰腺癌化疗的最佳一线药物。吉西他滨在改善胰腺癌主要症状,提高患者生存率方面优于5-FU的报道是一个重要突破,目前很多关于吉西他滨单药或者联合其他药物或放疗的临床试验正在进行。另外,有证据表明,表皮生长因子受体抑制剂埃罗替尼(erlotinib)联合吉西他滨能提高患者生存率,然而单独应用吉西他滨仍然是转移性胰腺癌的治疗选择。
在过去十几年中,胰腺癌化疗取得的进展有限,现在许多研究关注胰腺癌分子水平的靶向治疗。与胰腺癌关系密切的是表皮生长因子受体(EGFR)及其下游信号分子(Ras-Raf-MEK-ERK轴)、促血管生长因子包括VEGF、血小板源性生长因子(PDGF)和基质金属蛋白酶等。针对这些分子靶向治疗的Ⅰ、Ⅱ和Ⅲ期临床试验正在进行。
胰腺癌术后生存预测因素
既往研究证实,无淋巴结转移、肿瘤原发灶直径<2
cm、肿瘤分化好或中度分化、切缘癌细胞阴性以及无血管浸润是胰腺癌的有利预后因素。其他因素如肿瘤生物学特征、手术后Ca 19-9水平和辅助治疗的应用均可影响预后。
小 结
胰腺癌恶性程度高,起病隐匿,预后很差。外科手术可延长患者生存期,术后辅助化疗也可提高生存率。现在胰腺癌的标准治疗是外科手术联合辅助化疗。今后在胰腺癌诊断、流行病学、肿瘤生物学以及辅助和基因治疗方面的进展可能有助于提高胰腺癌患者的生存率。
|
